脳疾患トランスレーショナル研究グループ
グループ紹介

グループリーダー
樋口 真人 M.D., Ph.D.
ポジトロン断層撮影(PET)をはじめとする分子イメージング技術は、同じ手法で小動物(マウス・ラットなど)とヒトの脳機能と分子病態を解析できるという利点を有します。私たちは、精神疾患(うつ病・統合失調症など)ならびに神経疾患(認知症など)のモデル動物と患者さんの双方から得られる画像情報を有機的に結びつけることにより、疾患が起こるメカニズムを解明し、このメカニズムに基づいて疾患を診断・治療するための研究に取り組んでいます。
研究紹介
精神・神経疾患の分子病態に関する基礎と臨床を双方向につなぐ研究
-
1. 認知症の原因物質である凝集性タンパクの画像化
代表的な認知症であるアルツハイマー病では、アミロイドβとタウという2種類のタンパク質が、脳内で線維状のゴミ(凝集体)を形成して蓄積します。これに伴って神経細胞が障害を受けて、認知症が発症・進行すると考えられています。タウはアルツハイマー病以外の様々な認知症でも、中核病変として脳内に蓄積することが知られています。私たちは認知症モデルマウスを使ってタウの蓄積をPETで画像化する薬剤「PBB3」を開発し、アルツハイマー病や関連する認知症の患者さんでタウ病変を可視化することに、世界に先駆けて成功しました。
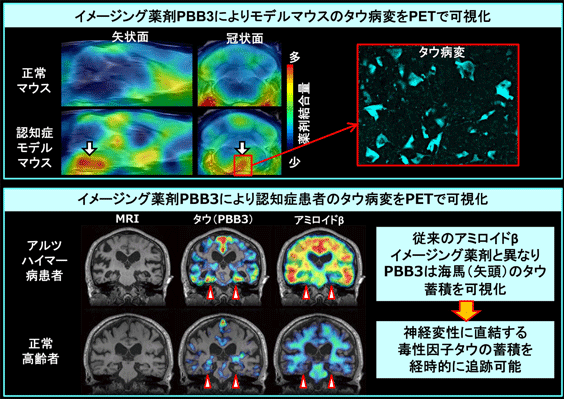
タウ病変を脳内に形成する認知症モデルマウスに、ラジオアイソトープで標識したPBB3を注射し、PETを撮像することで、タウ蓄積を生体で画像化できることが証明されました。次いでPBB3をヒトに応用し、アルツハイマー病患者のタウ蓄積を可視化することに成功しました。記憶の出し入れに関わる海馬(矢頭)では、タウの蓄積は顕著ですがアミロイドβの蓄積は軽微で、MRIで見ると目立った萎縮が認められることから、アミロイドβ以上にタウが神経細胞死に関わることが示唆されます。
PBB3は蛍光を発する特性も持つことから、二光子レーザー蛍光顕微鏡の技術を駆使して、モデルマウスの生体脳における個々のタウ病変を画像で捉えることが可能になりました。これによってタウ病変の形成と神経細胞死の関係を、リアルタイムな手法で解析できるようになりました。
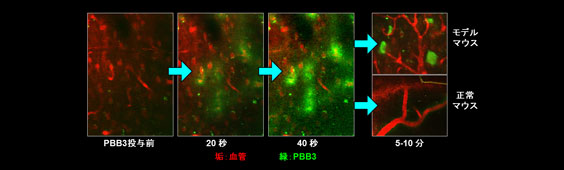
二光子レーザー顕微鏡により、マウスの脳内を一細胞レベルの解像度で画像化することが可能です。赤色は血管で、SR101という色素で標識してあります。この状態でPBB3を注射すると、PBB3は毛細血管から速やかに脳内に入ります。タウ病変を脳内に形成するモデルマウスでは、PBB3は神経細胞内のタウ凝集体に結合して病変を光らせます。このようにイメージング薬剤の動態を、リアルタイムで解析することが可能です。また、この技術を用いることで、同一の細胞、同一の病変を毎日、あるいは毎週撮影できるので、タウ病変形成や神経細胞死などの病態の経時変化を、詳細に追跡することが可能です。
アミロイドβの画像化についても、世界初となる認知症モデルマウスのPETを実現し、ヒトとマウスの画像比較を通じて、PETで捉えているアミロイドβは神経毒性が強い性質を持つアミロイドβ亜種であることをつきとめました。
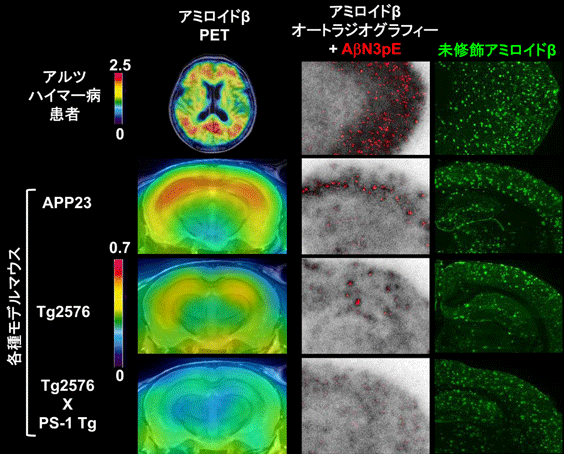
PETによる脳内アミロイドβ蓄積の画像化。スケールはPET薬剤の脳内結合量で、モデルマウスではアミロイドβが脳内に多量に蓄積するにもかかわらず、PETで見えるアミロイドβは、患者さんよりもはるかに少ないことが分かります。この理由をオートラジオグラフィーと免疫染色という手法で調べたところ、アミロイドβが切断・修飾されてできたAβN3pEという亜種の蓄積が、PET薬剤の結合と深く関わっており、さらにこの亜種が神経毒性を発揮することも分かりました。
-
2. 精神・神経患者における脳内炎症・神経免疫の役割を解明
脳内で免疫応答を担当するミクログリアなどのグリア細胞は、活性化にともなってトランスロケータータンパク(TSPO)という分子を多く発現するようになります。私たちはPETでTSPOを画像化する薬剤を独自に開発し、認知症モデルマウスの生体脳で神経炎症を可視化することに、国内外に先駆けて成功しました。それにより、ミクログリアの活性化にはアミロイドβやタウを除去して神経細胞を保護する「よい活性化」と、神経細胞を攻撃しアミロイドβやタウの蓄積を加速する「悪い活性化」が存在することが分かりました。この技術をヒトに応用し、認知症病態における「よいミクログリア」と「悪いミクログリア」の役割を明らかにする取り組みを進めています。また、ミクログリアの活性化は認知症のみならず、うつ病などの精神疾患の発症にも関与することが示されており、その観点でモデル動物とヒトをつなぐ画像研究を推進しています。

アルツハイマー病(AD)患者脳では、アミロイドβ(組織標本の赤色)やタウの蓄積に伴って、TSPO陽性の「悪い」ミクログリア(組織標本の緑色)が増加します。「悪い」ミクログリアは、タウ病変を形成する認知症モデルマウスの脳内でも増加します。PETとMRIにより、タウの蓄積、TSPO増加、海馬(点線で囲った領域)をはじめとする脳部位の萎縮が、密接な相互関係を有することが示されています。
-
3.神経伝達異常が脳機能に及ぼす影響を解明するイメージング技術開発
ドーパミン系、セロトニン系、ノルアドレナリン系、グルタミン酸系、GABA系などの各種神経伝達系は、脳活動を分子レベルで支えていますが、精神・神経疾患では異常をきたし、これが症状の出現に密接につながると考えられています。私たちはモデルマウス・ラットとヒトでPETにより神経伝達物質の受容体やトランスポーターを画像化し、伝達物質放出や受容体の変化を解析しています。これと並行して、二光子レーザー顕微鏡と機能的MRIによる脳活動のイメージングや、MRスペクトル分析による伝達物質の測定を行い、神経伝達系の変化が脳の活動にいかなる影響を及ぼすかを、細胞レベル・回路レベル・全脳レベルで明らかにすることを目指しています。
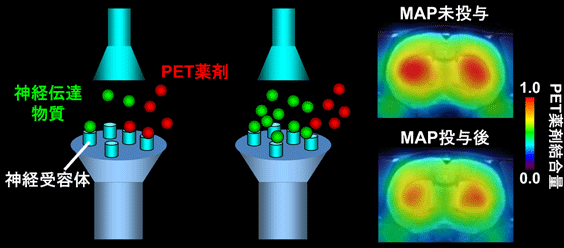
ラット脳におけるドーパミンD2受容体のPET画像。PET薬剤はD2受容体に結合しますが、神経伝達物質であるドーパミンの放出が増加すると、ドーパミンに受容体を奪われてPET薬剤の結合が減少します。メタンフェタミン(MAP)という薬剤を投与すると、ドーパミン放出が増加することが、PET薬剤の結合減少で証明できます。
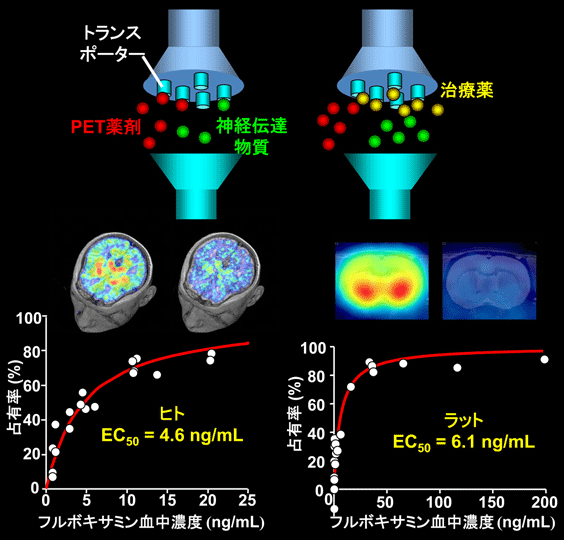
ヒトとラットの脳におけるセロトニントランスポーターのPET画像。PET薬剤はトランスポーターに結合しますが、うつ病の治療薬であるフルボキサミンがトランスポーターに結合すると、PET薬剤は治療薬にトランスポーターを奪われた形となり、脳内結合量が減少します。これを利用して、治療薬が脳内のトランスポーターをどれだけ占拠したか(占有率)をPETで測定できます。治療薬の血中濃度と脳内トランスポーターの占有率の間には一定の関係があり、50%の占有を起こす血中濃度(EC50)はヒトとラットで同様の値になります。これを利用して、ヒトで治療効果を発揮する薬剤の投与法や投与量を、ラットで予測することが可能です。